导读:
Lyra Therapeutics推进CRS领域的创新治疗方案。
(来源:网络)
Lyra是一家临床阶段Biotech,位于沃特敦,马塞诸萨州。
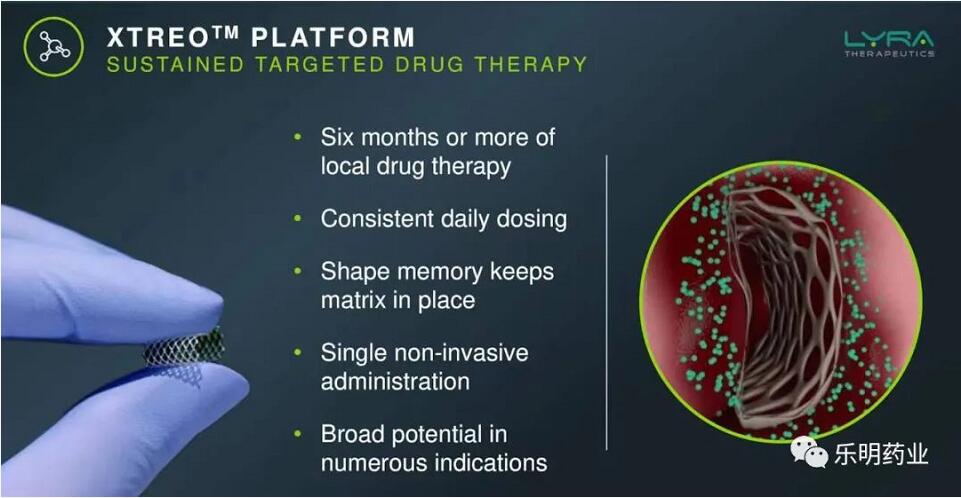
利用XTreo技术平台递送药物,单次给药,持续释放。
公司致力于开发药械组合,治疗眼、耳、喉局部组织疾病。
01
目前公司主要聚焦于慢性鼻窦炎 (Chronic Rhinosinusitis CRS)治疗领域。在美国,12%的人群患有鼻窦炎,大约1400万人患有慢性鼻窦炎,并遭受持续性的症状困扰。

(来源:网络)
目前关于慢性鼻窦炎的一线治疗药物为鼻喷类固醇或口服类固醇,但是鼻喷类固醇有两方面缺陷,一是通过鼻腔药物不能到达深部炎症部位,二是一天内需要多次给药,给患者带来不便。口服类固醇由于副作用大,限制了进一步使用。因此,慢性鼻窦炎领域需要更加有效,而且依从性更佳的治疗药物,该领域存在未获满足的临床需求。

(来源:网络)
Lyra利用专有的平台技术XTreo,将类固醇递送至炎症部位,并能够持续6个月释放,解决目前药物治疗的不足。
关于XTreo技术,包含3个部分:生物相容性网状支架(使药物的释放表面积最大化)、弹性基质和药物释放高分子(实现药物的恒速释放)。

(来源:网络)
公司目前有2个在研品种LYR-210和LYR-220。LYR-210和LYR-220递送的活性成分均是糠酸莫米松,区别在于LYR-210用于未手术的人群,LYR-220用于手术后的人群。

(来源:网络)
LYR-210
LYR-210目前处于phase3 阶段,临床招募中。名为LANTERN Stu(NCT04041609)(2019年开始,2021年2月结束,共招募71名患者,糠醛莫米松的递送剂量为7500ug,主要终点事件为4周的临床症状改善,次要终点事件为24周的生活质量改善)的临床2期试验结果显示,70%的患者达到主要临床终点事件。
2021年LYRA与联拓生物达成战略合作和独家许可协议,双方将携手在大中华区(中国大陆以及港澳台地区)、韩国、新加坡和泰国,对LYR-210进行开发和商业化。
LYR-220
LYR-220的目标人群为手术后的慢性鼻窦炎患者,目前Phase2正招募中,计划招募70名,预计2023年6月结束,名为BEACON Study(NCT05035654)。
参考资料:
https://lyratherapeutics.com/
https://seekingalpha.com/article/4502632-lyra-therapeutics-first-look
https://www.lianbio.com/cn/news/lyra-therapeutics-and-lianbio-announce-strategic-partnership-and-exclusive-license-agreement-to-develop-and-commercialize-lyr210-in-greater-china-and-other-asian-markets/
备注:本文内容仅供医学,药学等专业人士参考阅读。
部分图片来源于网络,如有侵权,请联系删除。