
2023年11月14日IntelGenx Corp宣布,瑞典医疗产品管理局(MPA)、瑞典伦理审查局和瑞典生物样本库已批准孟鲁司特贴剂(VersaFilm ®)的治疗帕金森病(PD)的临床II期(MONTPARK)研究计划。

IntelGenx 是一家领先的药物输送公司,专注于药物薄膜的开发和制造。IntelGenx 的卓越薄膜技术,包括VersaFilm®、DisinteQ™、VetaFilm® 和VevaDerm™(透皮贴剂)等解决未满足医疗需求的新一代制剂产品。

图片来源:IntelGenx公司
MONTPARK 临床II期研究(CT号2023-504278-39-00)是一项平行随机、双盲、安慰剂对照多中心试验,将研究口服大剂量孟鲁司特对早、中期PD患者的疗效。该研究将招募约90名患者,他们将接受30mg孟鲁司特口腔粘膜贴剂 VersaFilm ®或安慰剂,每天两次,持续18个月,然后进入3个月的洗脱期。符合资格的受试者在入组时必须接受左旋多巴治疗或其他多巴胺能对症药物治疗。该研究预计将于 2024 年第一季度开始招募,预计研究持续时间约为24至30个月,具体取决于实际招募率。
IntelGenx 首席执行官德怀特·戈勒姆 (Dwight Gorham) 表示:“我们很高兴这项试验已获得 MPA 的批准,并期待尽快开始患者招募。”瑞典卡罗林斯卡大学医院PD病理专家佩尔·斯文宁森教授主持这项多中心临床研究,他之前证明了40mg孟鲁司特在 PD 患者中的安全性和耐受性,瑞典研究委员会也授予2000万瑞典克朗(约200万美元)拨款来资助这项临床研究。MONTPARK将评估每天接受60mg的孟鲁司特剂量治疗效果。孟鲁司特口腔粘膜贴剂VersaFilm ®生物利用度(比片剂提高约50%),孟鲁司特目前上市口服剂型包括片剂,颗粒,咀嚼片,单位规格在4mg~10mg,口腔粘膜贴剂可以减少服用口服单位制剂的数量。

帕金森症(Parkinson's disease,PD)是继阿尔茨海默症(AD)之后第二常见的神经退行性疾病,全球估计有900万PD患者,流行病学调查研究显示欧美国家60岁以上帕金森病患病率达到1%,80岁以上超过4%,我国65岁以上人群患病率为1.7%,与欧美国家相似。我国是世界上人口最多的国家,未来我国帕金森病患病人数将从2005年的199万人上升到2030年的500万人,几乎占到全球帕金森病患病人数的一半。随着疾病的进展,帕金森病的运动和非运动症状会逐渐加重,一方面会损害患者本身的日常活动,另一方面,也会带来巨大的社会和医疗负担。1
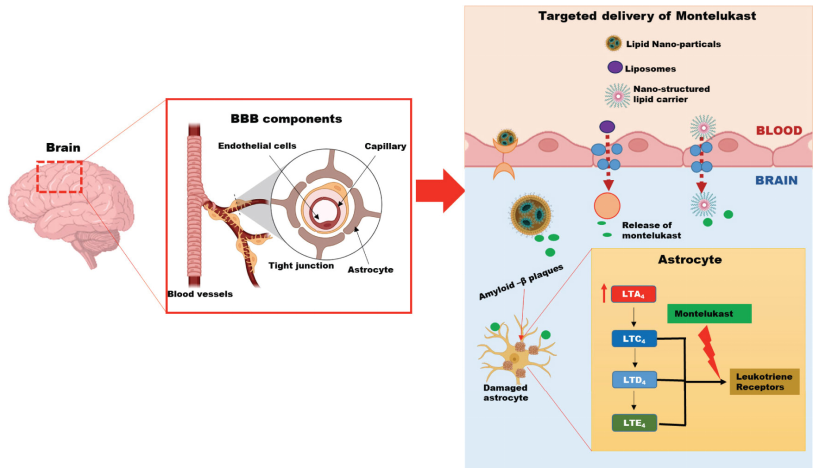
目前尚无神经保护或疾病缓解治疗的特效方法。PD运动功能障碍的标准治疗是基于使用左旋多巴等药物增加患者多巴胺能传递。来自多项患者研究和动物模型的证据表明,在PD疾病过程中存在显着的免疫因素,强调免疫调节作为一种潜在的治疗策略。孟鲁司特是一种 CysLT 1拮抗剂2,可通过抑制 CysLT1 减少神经炎症。早期临床研究结果表明其在治疗PD和AD等各种神经退行性疾病方面具有潜在的机会。例如,孟鲁司特是最常用的白三烯受体拮抗剂,用于治疗哮喘和季节性过敏。它的白三烯拮抗作用也有利于减少白三烯对神经炎症的有害影响,神经炎症是AD等神经退行性疾病的一个标志性特征。现有市售制剂孟鲁司特目前存在生物利用度差和吸收减少等挑战,反映药物递送到中枢神经系统有效性不足。另一方面,靶向药物递送是克服此类挑战很有机会的方法。近年全球药物研发团队开展了孟鲁司特口腔粘膜贴剂,纳米制剂、鼻凝胶、固体脂质制剂、纳米结构脂质载体 (NSLC) 等新方法的研究,以期实现神经系统疾病治疗理想的效果。3
孟鲁司特药物递送方法及其作用机制

本次获批孟鲁司特口腔粘膜贴剂临床II期研究是基于IntelGenx公司VersaFilm®技术平台开发的,该公司官网介绍VersaFilm®技术可以施用在舌上、脸颊内膜和舌下,虽然药物进入口腔,但API的释放机理与常见的口服制剂不同,VersaFilm®口腔粘膜贴剂主要是通过粘膜吸收进入循环系统,上一级临床研究中检测脑脊液和血液中孟鲁司特含量,口腔粘膜贴剂对整个消化系统各个脏器影响较小,如下图所示:
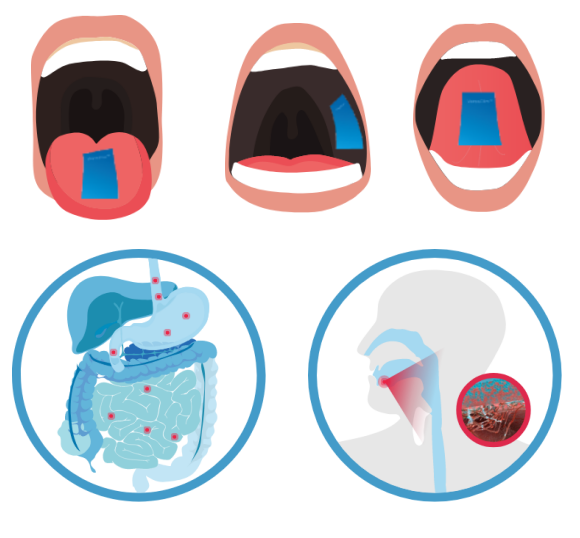
图片来源:IntelGenx公司
2020 年 3 月 4 日,美国食品药品监督管理局(FDA)发布了药品安全警告,明确指出,针对孟鲁司特钠在精神健康方面的副作用增加一则黑框警告,并建议限制其在过敏性鼻炎(AR )中的使用。4

图片来源:FDA官网
基于2004年1月至2020年9月FDA不良事件报告系统,分析白三烯受体拮抗剂、H1抗组胺剂、吸入性糖皮质激素相关神经精神事件,结果三组分别收集到病历数5201、3226、1048,白三烯受体拮抗剂相关精神神经事件在4-6岁患者中更常见,H1抗组胺剂在18-44岁、吸入性糖皮质激素组在65岁患者中发生精神神经事件更常见。孟鲁司特用药后大多数精神神经症状发生在用药后10天内,因精神神经事件死亡率在H1抗组胺剂组更高。5
尽管已经有FDA的黑框警告,但仍有许多研究对孟鲁司特与神经精神症状的相关性提出质疑。一篇发表在哮喘杂志的序列分析表明,在针对两千多名孟鲁司特治疗前后6种精神病药物的敏感性分析后,发现孟鲁司特的使用与多种神经精神症状的风险增加无关。6
MONTPARK试验将评估每天接受60mg(30mg,bid)的孟鲁司特治疗轻度、中度帕金森症患者的治疗效果,试验设计给药持续18个月。孟鲁司特口腔粘膜贴剂VersaFilm ®生物利用度(比片剂提高约50%),本次瑞典监管机构批准MONTPARK计划,说明他们认可了口腔粘膜贴剂的药物递送安全性,推动了探索大剂量使用孟鲁司特治疗PD、AD等神经退行性疾病的临床研究。