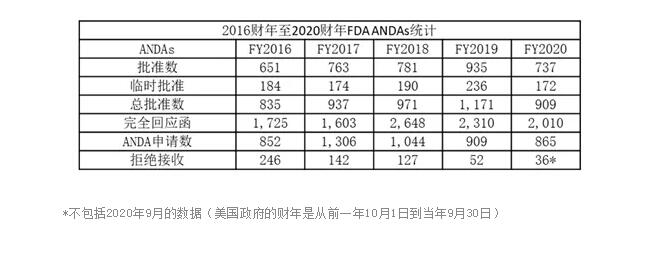
在连续四年创下仿制药新药申请(ANDA)批准数量的记录之后,美国食品药品管理局(FDA)打破了历史记录,与2019财年相比,2020财年批准的仿制药减少了22%。
在2020财年,FDA总共批准了909个ANDA,737个正式批准和172个临时批准,而2019财年则达到创纪录的1,171个ANDA。完整回应也从2019财年的2,310下降至2,010。(相关报道:仿制药品批准的另一个创纪录年份,但有关竞争的问题仍然存在, 2019年10月16日;FDA再次创下了仿制药品批准数量的记录, 2018年10月11日)。
*不包括2020年9月的数据(美国政府的财年是从前一年10月1日到当年9月30日)
在批准量下降之前,FDA就已加大了对仿制药积压申请的审评关注,这是前FDA专员斯科特·戈特利布(Scott Gottlieb)倡导的药物竞争行动计划的一部分,在第二次仿制药使用者费用修正案(GDUFA II)中强调于实行的最初三年对旧申请采取行动,从而导致了此前创纪录的高批准量。
由于在进行设施检查和转移资源以应对COVID-19方面受到限制,目前尚不清楚COVID-19对FDA批准仿制药有多少影响。FDA表示,正在努力履行其使用费承诺,但官员们承认,由于无法进行现场的预先批准检查,错过了某些既定日期。(相关报道:FDA解释了COVID-19对申请,正式会议, 2020年5月27日;CDER高层官员讨论了预算重点,人员配备和COVID-19, 2020年10月16日)
尽管2019财年的批准数量有所下降,但ANDA批准的数量仍然高于2016财年,仅略低于2017财年和2018财年的数量。
由于FDA收到的ANDA提交数量下降也是几年以来获得批准数量的减少的原因,从2017财年收到的1,306份申请达到巅峰开始到去年逐年下降。并且自2016财年以来,FDA发出拒绝接收(RTR)的申请数量也在稳步下降。
关键词:仿制药新药申请,美国食品药品监督管理局(FDA),仿制药

乐明药业(苏州)有限公司是一家专注于药物创新制剂研发、生产和销售的高新技术制药企业。公司的前身上海乐明生物科技有限公司成立于2001年12月,至今已有近二十年历史。乐明药业的公司总部位于苏州吴中生物医药产业园,在北京亦庄设有研发中心,同时乐明药业积极布局海外,在美国和日本分别设有BD部门,负责海外项目的引进工作。